医疗器械质量管理体系
ISO13485
简介
ISO13485是用适用于医疗器械法规环境下的质量管理体系标准,其全称是《医疗器械 质量管理体系 用于法规的要求》。虽然ISO 13485是基于ISO 9001的计划、执行、检查、行动(PDCA)的流程模型理念,但其目的是确保医疗器械的合规。
因此,ISO13485更有针对性,并且对质量管理体系提出了更高的文件化的要求。ISO 13485旨在帮助医疗器械制造商建立质量管理体系,并维持体系的有效性。它能确保医疗器械在设计、开发、生产、组装、运输、处置等所有阶段的安全性并符合预期用途。
认证依据包括
ISO/IEC17021:2015-1《合格评定 管理体系审核认证机构的要求》
IAF MD 9:2017 《ISO/IEC 17021 应用于ISO13485医疗器械质理管理体系》
YY/T0287-2017/ ISO 13485:2016《医疗器械质量管理体系用于法规的要求》
ISO 14971:2007 医疗器械 风险管理对医疗器械的应用
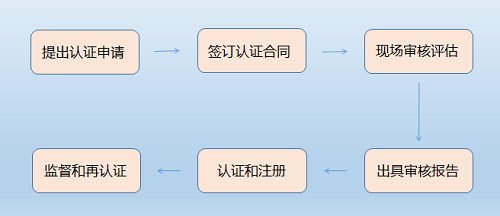
认证流程
管理体系相关认证的流程基本一致,企业申请时不需要特别记录。流程一般包括:提交申请、签订合同和交预付款;初审(第一阶段审核/文件审查,第二阶段审核/现场审核);认证决定;结算费用,注册发证;每年的监督审核(次数略有不同);证书期满后的再认证等环节。
认证规则:![]() 医疗器械质量管理体系认证规则.pdf
医疗器械质量管理体系认证规则.pdf
如需进一步了解,请致电我公司市场部门:010-84724911







 京公网安备11010502055098号
京公网安备11010502055098号




